Este artículo fue actualizado por última vez el julio 5, 2023
Terapéutica de ARNm: ¿deberían clasificarse como terapia génica o vacunas?

Terapéutica de ARNm: ¿deberían clasificarse como terapia génica o vacunas?
Un artículo reciente titulado “ARNm: ¿vacuna o terapia génica? Las cuestiones reglamentarias de seguridad” que apareció en el International Journal of Molecular Sciences el 22 de junio de 2023:
… examina la cuestión de si las vacunas de ARNm de COVID-19 deben clasificarse o no como terapia génica y si fueron suficientemente examinadas por los reguladores gubernamentales, una de las preguntas clave que la corriente principal ha barajado al “interior de la teoría de la conspiración” medios de comunicación, verificadores de hechos y funcionarios gubernamentales de salud.
Comencemos definiendo un producto de terapia génica (GTP):
1.) Según la Administración de Drogas y Alimentos de los Estados Unidos, la terapia génica es una intervención médica basada en la modificación del material genético de las células vivas. Las células pueden alterarse in vivo mediante terapia génica administrada directamente al sujeto.
2.) Según la Agencia Europea de Medicamentos (EMA) (2009), un GTP:
(a) contiene una sustancia activa que contiene o consiste en un ácido nucleico recombinante utilizado o administrado a seres humanos con el fin de regular, reparar, reemplazar, agregar o eliminar una secuencia genética; y
(b) en sus efectos terapéuticos, profilácticos o de diagnóstico, se relaciona directamente con la secuencia de ácido nucleico recombinante que contiene, o con el producto de la expresión genética de esta secuencia.
Ahora, veamos la definición de una vacuna:
1.) Según los CDC de los Estados Unidos, una vacuna es “una preparación que se usa para estimular la respuesta inmunitaria del cuerpo contra las enfermedades”. Esta definición se cambió en septiembre de 2021 y anteriormente decía “un producto que estimula el sistema inmunitario de una persona para producir inmunidad contra una enfermedad específica, protegiendo a la persona de esa enfermedad”.
2.) Según la normativa europea, las vacunas son productos capaces de producir inmunidad activa y contienen antígenos capaces de inducir inmunidad activa frente a un agente infeccioso.
Tenga en cuenta que, según la EMA, el principio activo de las vacunas de ARNm de COVID-19 es el ARNm, no un antígeno, lo que significa que los productos de ARNm no deben considerarse vacunas.
El artículo de Helene Banoun, una investigadora francesa independiente con un extenso historial editorial que puedes ver aquí se abre con esto:
“Las vacunas contra el COVID-19 se desarrollaron y aprobaron rápidamente en respuesta a la urgencia creada por la pandemia. No existía una normativa específica en el momento de su comercialización. Por lo tanto, las agencias reguladoras los adaptaron con carácter de urgencia. Ahora que ha pasado la emergencia pandémica, es hora de considerar los problemas de seguridad asociados con esta rápida aprobación…
Algunas de las pruebas a las que se han sometido como vacunas han arrojado resultados no conformes en términos de pureza, calidad y homogeneidad de lotes. La biodistribución amplia y persistente de los ARNm y sus productos proteicos, incompletamente estudiada debido a su clasificación como vacunas, plantea problemas de seguridad. Los estudios posteriores a la comercialización han demostrado que el ARNm pasa a la leche materna y podría tener efectos adversos en los bebés amamantados. La expresión a largo plazo, la integración en el genoma, la transmisión a la línea germinal, el paso a los espermatozoides, la toxicidad embrio/fetal y perinatal, la genotoxicidad y la tumorigenicidad deben estudiarse a la luz de los eventos adversos informados en las bases de datos de farmacovigilancia. También debería haberse evaluado la posible transmisión horizontal (es decir, el desprendimiento). Debe llevarse a cabo una vigilancia exhaustiva de las vacunas. Esperamos que estos controles sean necesarios para futuras vacunas de ARNm desarrolladas fuera del contexto de una pandemia”.
Como todos debemos saber, las vacunas de ARNm de COVID-19 fueron las primeras vacunas de ARNm comercializadas al público y, como una nueva clase de vacunas, deben estar sujetas a un escrutinio adicional dado que se basan en nuevas tecnologías. Dicho esto, las vacunas de ARNm contra una enfermedad infecciosa han sido excluidas de las regulaciones de productos de terapia génica (GTP) por regulaciones tanto en los Estados Unidos como en la Unión Europea, en gran parte porque las terapias de ARNm no se mencionan en las pautas actuales.
En este estudio, el autor comparó los controles requeridos por las regulaciones GTP con los que realmente se aplicaron a las vacunas de ARNm COVID-19. y encontró que debido a que las vacunas de ARNm de COVID-19 no se clasificaron como terapia génica, las pruebas que normalmente se requieren para los productos de terapia génica no seguían, incluidas las siguientes (entre otras):
1.) Expresión a largo plazo
2.) Integración en el genoma
3.) Transmisión a la línea germinal (es decir, semen, gónadas, gametos)
4.) Paso a toxicidad embrionaria/fetal y perinatal,
5.) Genotoxicidad
6.) Tumorigenicidad
7.) Estudios de vertimiento/transmisión a un tercero
8.) Excreción en el medio ambiente
Las vacunas de ARNm de COVID-19 se apresuraron a producir y distribuirse en respuesta a la percepción de una emergencia de salud global en cuestión de meses con revisiones continuas en las que los datos se envían a los organismos gubernamentales de salud y los revisan a medida que están disponibles, antes de la publicación completa. El paquete de datos está disponible para los reguladores y el público en general. Las fases finales del ensayo no se completaron y aún no se completaron hasta meses o años después de que los productos de ARNm se inyectaron en los brazos de miles de millones de humanos.
De acuerdo con la FDA, se debe realizar un seguimiento a largo plazo de los eventos adversos asociados con las GTP durante al menos cinco años para nuevas condiciones clínicas, incluidas nuevas neoplasias malignas, nueva incidencia o exacerbación de trastornos neurológicos preexistentes, nuevas incidencia o exacerbación de un trastorno reumatológico u otro autoinmune previo, nueva incidencia de un trastorno hematológico y nueva incidencia de infección (potencialmente relacionada con el producto).
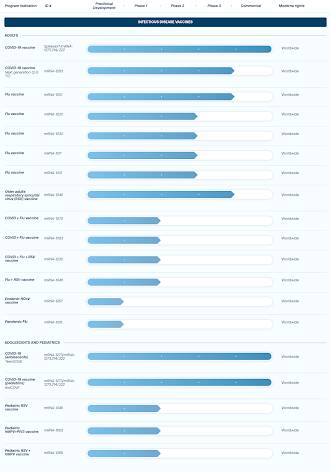
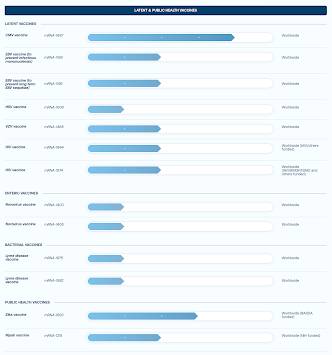
La aplicación de pautas estrictas para la terapia de ARNm es de importancia crítica dado que Big Pharma, particularmente Moderna, planea lanzar “vacunas” contra la influenza de ARNm, así como “vacunas” contra el cáncer, como se muestra en este gráfico lo que demuestra que varias de estas vacunas ya están en fase 2 de ensayos:
Lo que es aún más preocupante es que Big Pharma planea reemplazar las vacunas tradicionales con vacunas de ARNm.
Cerremos con algunas citas adicionales y la conclusión del artículo de Helene Banoun con mis negritas:
“El monitoreo de seguridad a largo plazo de las GTP se requiere durante varios años, mientras que, para las vacunas, generalmente solo se lleva a cabo durante unas pocas semanas. Esto no debería ser aceptable, dada la persistencia del medicamento y la proteína expresada. Los resultados conocidos de las terapias contra el cáncer y las vacunas de ARNm podrían llevarnos a anticipar problemas de seguridad y eficacia. En el caso de los ARNm contra el cáncer, la gran mayoría de los ensayos clínicos abiertos se han llevado a cabo en un número muy pequeño de pacientes, con resultados no publicados o negativos. Los estudios aleatorizados también mostraron resultados negativos, informando eventos adversos más frecuentes en el grupo de tratamiento…
Desde el punto de vista de la salud pública, y sabiendo que los ARNm anti-COVID-19 considerados como vacunas no han sido sometidos a todos los controles estrictos requeridos para las GTP, se podría objetar que un producto destinado a la mayoría de la población mundial sana debería estar sujeto a una regulación más estricta que un GTP destinado a unas pocas personas raras que padecen una enfermedad rara o cáncer…
El papel de las agencias reguladoras es garantizar la seguridad y eficacia de los medicamentos. La emergencia pandémica de la COVID-19 ha acelerado el cronograma de producción y uso clínico de las vacunas contra la COVID-19; por lo tanto, es posible que ciertos aspectos de seguridad no se hayan abordado por completo. Por lo tanto, es importante tener en cuenta estos aspectos en el futuro, para no socavar la confianza pública en las vacunas en general….
En el futuro, debería discutirse si todos los productos basados en ARNm deben estar sujetos a las mismas regulaciones y controles, se consideren o no vacunas. No se justifica someter los ARNm terapéuticos a controles estrictos cuando están destinados a pacientes que representan una pequeña proporción de la población humana y excluir de estos controles las vacunas de ARNm destinadas a la mayoría de la población humana sana”.
Terapéutica de ARNm


Be the first to comment